Titanisierung
Titan: Seit über 70 Jahren in der Medizin zu Hause
Titan ist aus der Medizin nicht mehr wegzudenken. Denn mit seinen hervorragenden Eigenschaften wird es den höchsten medizinischen Anforderungen gerecht. Neben den idealen mechanischen Eigenschaften wie Leichtigkeit und hoher Festigkeit wachsen Gewebs- und Knochenzellen besonders gut an Titanimplantaten an.
Diese hervorragende Körperverträglichkeit führt dazu, dass Titanimplantate ausgezeichnet in den menschlichen Organismus integriert werden. Daher wird Titan bereits seit 1946 in vielen medizinischen Bereichen verwendet.1
Implantate aus Titan – eine Auswahl:
- Zahnimplantate
- Knie- und Hüftgelenksprothesen
- Titanschrauben und Platten zur Stabilisierung von Brüchen
- Gehörknöchelchen-Implantate
- Titan-Clips z. B. in der Neurochirurgie
Bei den Beispielen handelt es sich um Titanimplantate aus Vollmetall, also rein aus Titan bestehend. War jedoch aufgrund der Anforderungen an das Implantat eine hohe Flexibilität und/oder Elastizität gefragt, kam Titan aufgrund seiner unflexiblen Materialeigenschaften lange Zeit nicht in Frage.
Titanisierung von Netzimplantaten
pfmmedical ist es bereits im Jahr 2000 gelungen, die Vorteile von Titan auf ein flexibles und elastisches Basismaterial zu übertragen, konkret auf ein Polypropylennetz.2
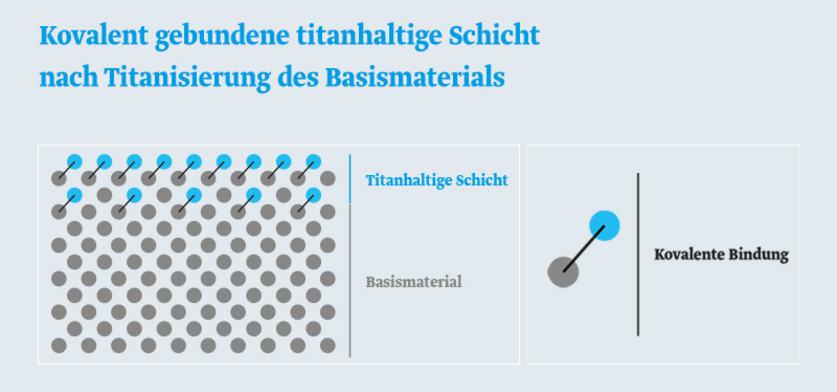
Bei dem einzigartigen Verfahren der Titanisierung wird der Kohlenstoff aus der titanhaltigen Schicht kovalent an Polypropylennetze gebunden. Kovalent gebunden bedeutet, dass eine atomare Bindung vorliegt.
Titanisierung schafft eine hydrophile Oberfläche
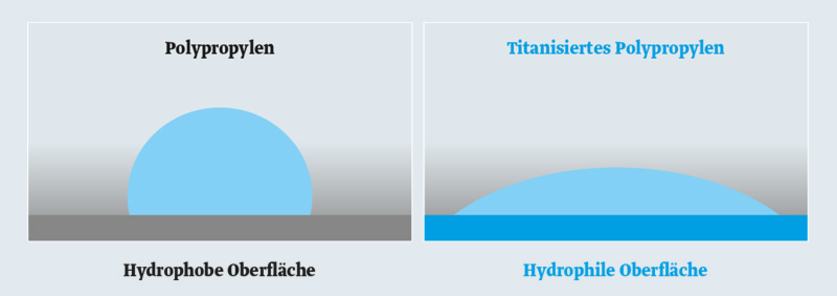
Das Ergebnis der Titanisierung: eine hydrophile (wasserliebende) Oberfläche. Durch die Titanisierung wird die ehemals hydrophobe (wasserabstoßende) Oberfläche des Polypropylens hydrophil. Dies zeigt ein einfacher Test mit einem Wassertropfen.
Auf der hydrophoben Oberfläche grenzt sich der Tropfen ab. Auf der titanisierten und daher hydrophilen Oberfläche breitet sich der Tropfen flächig aus.
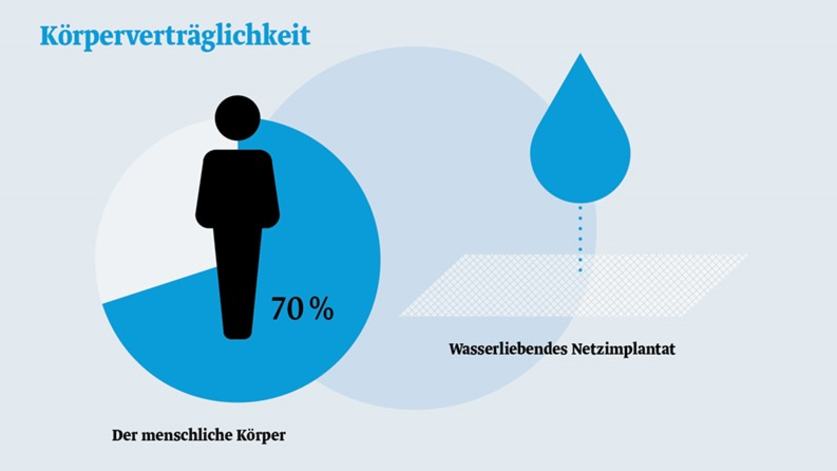
Der menschliche Körper besteht zu ungefähr 70 % aus Wasser. Die titanisierte und dadurch wasserliebende (hydrophile) Oberfläche unserer Netzimplantate führt somit zu einer besseren Verträglichkeit.4,10
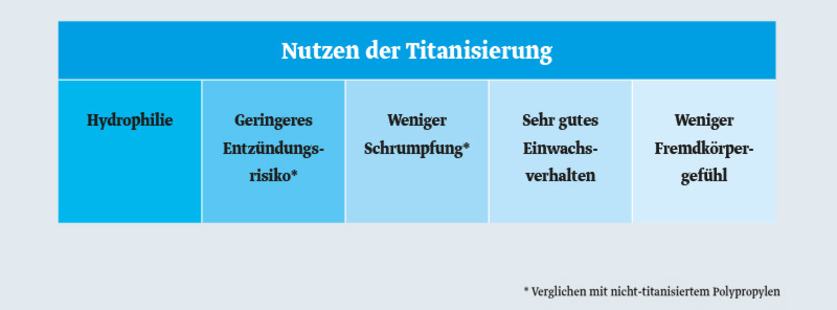
Die hydrophile Oberfläche eines titanisierten Netzimplantats bietet gegenüber einfachem, hydrophobem Polypropylen viele Vorteile:
Vorteile titanisierter Netzimplantate
Besseres Zellwachstum
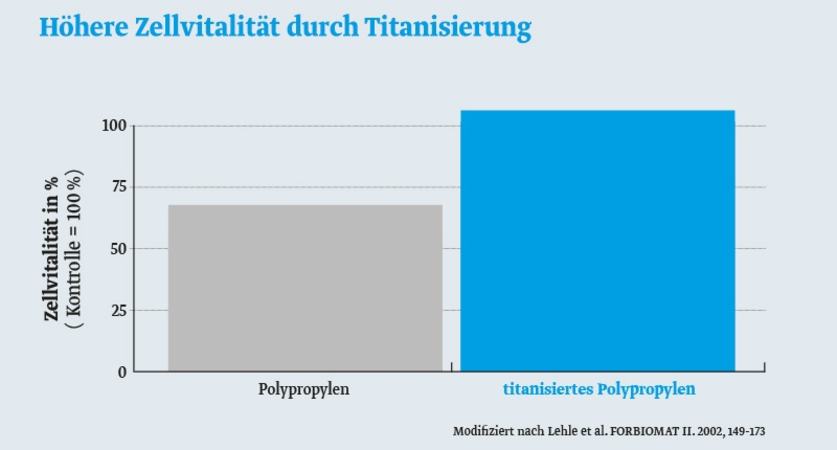
Im Vergleich mit einer Polypropylenoberfläche sind FibroblastenFibroblasten sind aufbauende Zellen. Sie produzieren alle Fasern und molekularen Bestandteile des Bindegewebes und verleihen diesem seine Struktur und Festigkeit. auf einer titanisierten Oberfläche vitaler und wachsen besser.3
Niedrigeres Entzündungsrisiko und bessere Verträglichkeit
Jedes Implantat löst eine Entzündungsreaktion aus. Je geringer diese ausfällt, desto verträglicher ist das Implantat im Körper.4
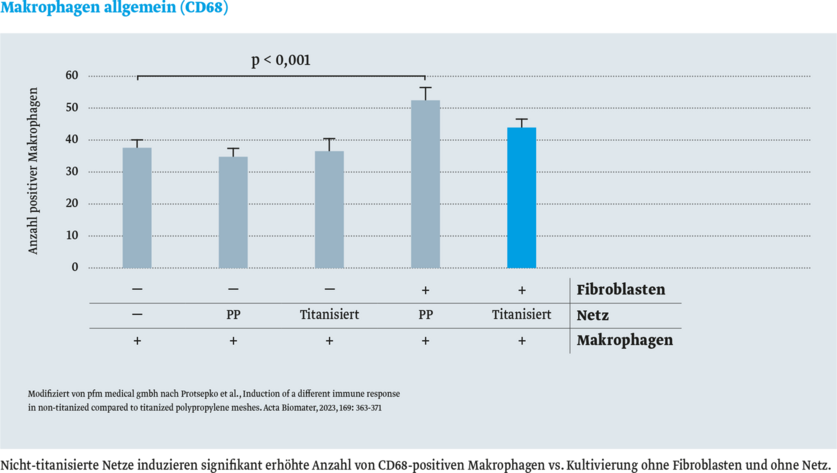
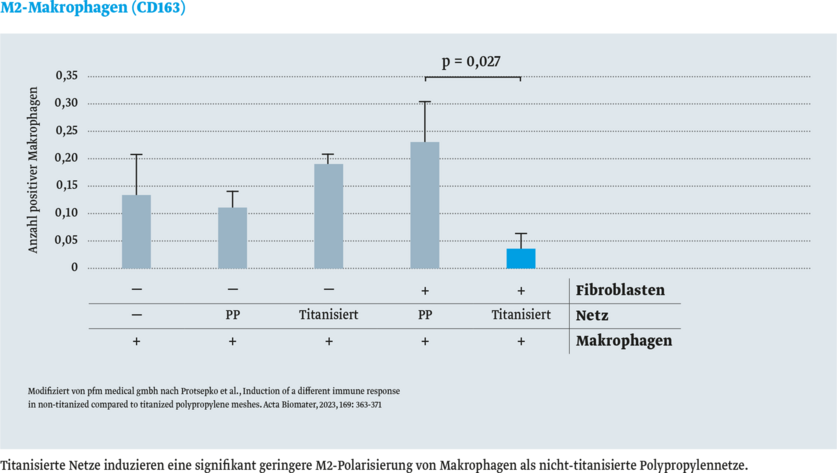
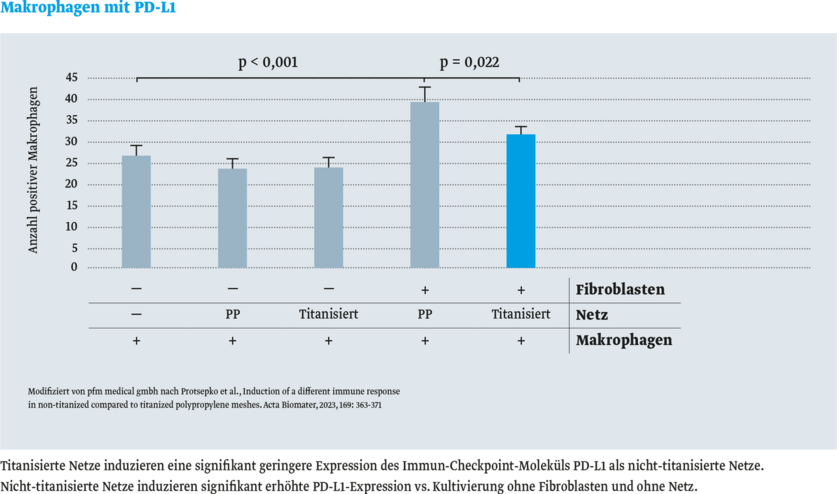
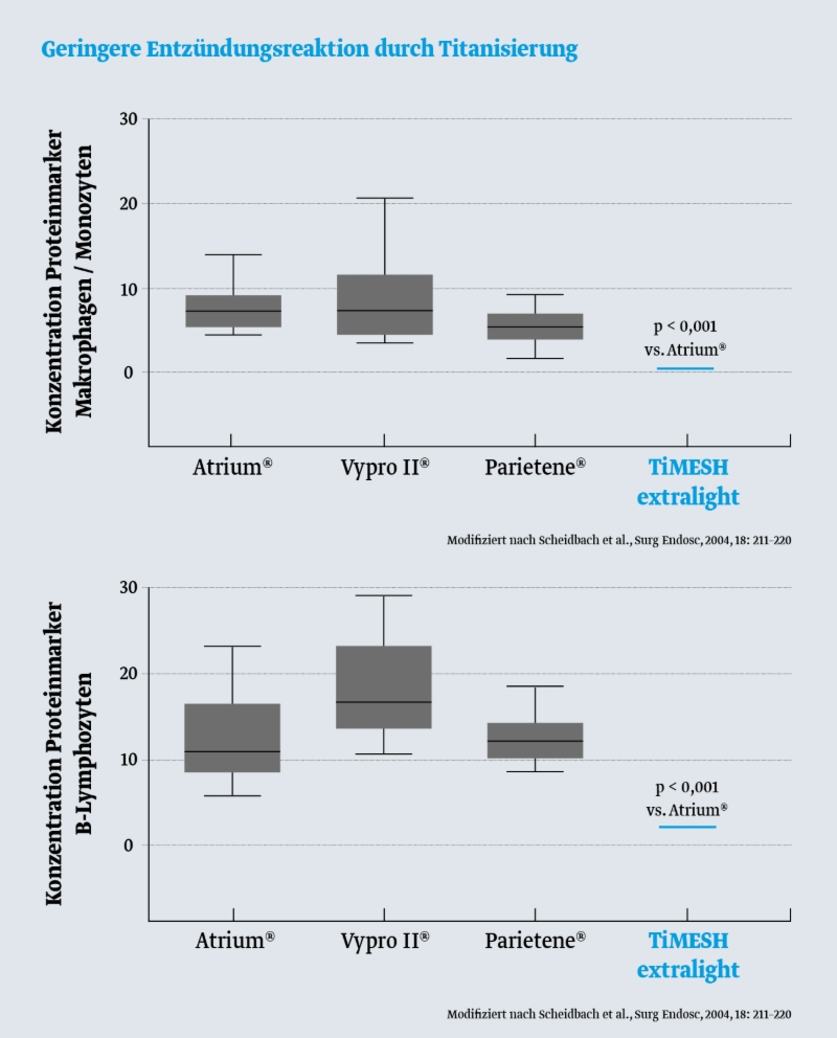
Die folgenden Abbildungen vergleichen die Konzentrationen von MarkerproteinenMarkerprotein sind bekannte Proteine, die als Standard bei Auftrennungen von Proteinen mitgeführt werden (Marker). für Entzündungszellen (Makrophagen und B-Lymphozyten) nach Implantation verschiedener Herniennetze im Tiermodell. Das titanisierte Herniennetz TiMESH zeigt die niedrigsten Konzentrationen dieser entzündungspezifischen Proteine.
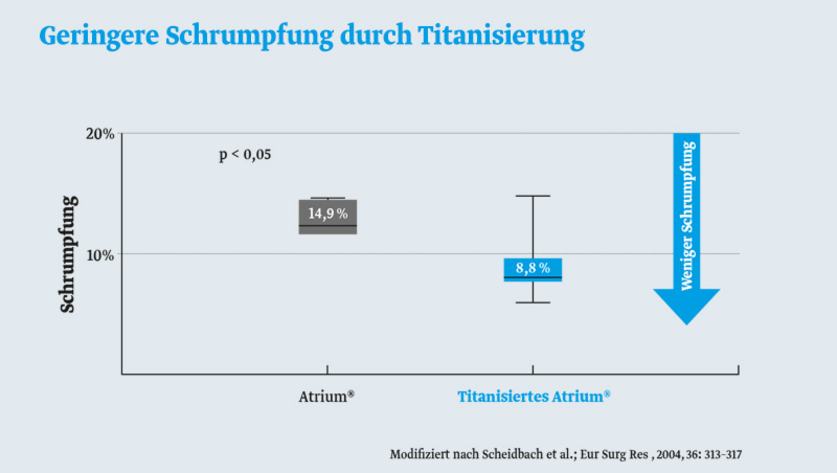
Weniger Narbenbildung und Netzschrumpfung
Generell gilt: je stärker die Entzündung, desto dicker die Narbe. Da die Entzündungsreaktion eines titanisierten Polypropylennetzes im Vergleich zu nicht-titanisierten Polypropylennetzen niedriger ist, fällt auch die Narbenbildung schwächer aus.5
Dies hat eine wichtige Folge. Die das Netz umschließende Narbenplatte schrumpft mit der Zeit weniger, und damit auch das Netz.6,7
Keine signifikante Immunreaktion
In der Studie von Protsepko et al. (2023) wurden unterschiedliche Immunantworten auf Netzmaterialien untersucht.
Titanisierte und nicht-titanisierte Polypropylennetze (PP) wurden hinsichtlich ihrer Immunantwort verglichen. Dazu wurden Makrophagen in vitro mit oder ohne Fibroblasten auf Netzmaterial kultiviert. Immunhistochemisch wurde Folgendes nachgewiesen:
- Makrophagen allgemein (CD68)
- M2-polarisierte Makrophagen (CD163)
- Immun-Checkpoint-Molekül PD-L1 (Programmed Cell Death-Ligand 1)
Das Ergebnis: in vitro wurde keine signifikante Immunreaktion mit titanisierten Netzen festgestellt.8
Warum fällt die Entzündungsreaktion geringer aus?
Unser Immunsystem wird aktiv, wenn es körperfremde Strukturen erkennt. Zum Beispiel Proteine, die eine unnatürliche Form angenommen haben. Eine solche unnatürliche Form nehmen z. B. wasserlösliche (hydrophile) Proteine wie Albumine an, wenn sie an hydrophobe Oberflächen binden. Diese Formänderung aktiviert Zellen des Immunsystems wie Makrophagen oder B-Lymphozyten. Diese Zellen treiben eine Entzündungsreaktion voran, an deren Ende die Bildung von Narbengewebe steht.
Hingegen binden hydrophile Proteine an eine hydrophile Oberfläche weitestgehend ohne Formänderung. Die Zellen des Immunsystems werden weniger stark aktiviert und die Entzündungsreaktion ist schwächer.
Da der Trigger an das Immunsystem für eine Entzündungsreaktion vermindert ist, fällt die Narbenbildung und die Netzschrumpfung geringer aus 5,6,7 und das umgebende Körpergewebe kann besser in das Netz einwachsen. Durch das sehr gute Einwachsverhalten des Implantates kommt es zu weniger Fremdkörpergefühl.9
Die durch die Titanisierung verbesserte Körperverträglichkeit wird genutzt um den Patienten-Outcome zu erhöhen und die Lebensqualität zu verbessern: als titanisiertes Netz für die Hernienchirurgie, die Brustchirurgie oder zur Beckenbodenrekonstruktion.
- Wintermantel, E., S.-W.H., Medizintechnik Life Science Engineering. 5 ed. 2009, Berlin Heidelberg: Springer-Verlag
- CE-Kennzeichnung des titanisierten Herniennetzes TiMESH: 2002
- Lehle K., Lohn S., Verbesserung des Langzeitverhaltens von Implantaten und anderen Biomaterialien auf Kunststoffbasis durch plasmaaktivierte Gasphasenabscheidung (PACVD), Abschlussbericht Forschungsverbund “Biomaterialien (FORBIOMAT II)”. 2002, 149–173
- Scheidbach H., Tamme C., Tannapfel A., Lippert H., Köckerling F., In vivo studies comparing the biocompatibility of various polypropylene meshes and their handling properties during endoscopic total extraperitoneal (TEP) patchplasty: an experimental study in pigs. Surg Endosc, 2004, 18(2): 211-220
- Scheidbach H., Tannapfel A., Schmidt U., Lippert H., Köckerling F., Influence of titanium coating on the biocompatibility of a heavyweight polypropylene mesh. An animal experimental model. Eur Surg Res, 2004, 36(5): 313-317
- Zhu L. M., Schuster P., Klinge U., Mesh implants: An overview of crucial mesh parameters. World J Gastrointest Surg, 2015, 7(10): 226-236
- Wood A. J., Cozad M. J., Grant D.A., Ostdiek A. M., Bachman S. L., Grant S.A., Materials characterization and histological analysis of explanted polypropylene, PTFE, and PET hernia meshes from an individual patient. J Mater Sci Mater Med, 2013, 24(4): 1113-1122
- Protsepko, O., Voisard, P., Kuhn, C., Maccagno, A., Dannecker, C., Jeschke, U., Pauli, F., & Garrido, F., Induction of a different immune response in non-titanized compared to titanized polypropylene meshes. Acta Biomater, 2023, 169: 363-371
- The SAGES Manual of Hernia Repair. 1 ed. 2013, New York: Springer-Verlag
- Horstmann R., et al., Impact of polypropylene amount on functional outcome and quality of life after inguinal hernia repair by the TAPP procedure using pure, mixed, and titanium-coated meshes. World J Surg., 2006. 30(9): p. 1742-1749
Studien zur Titanisierung
Netzimplantate für die Brustchirurgie
Übersicht: Netze für die rekonstruktive und plastische Brustchirurgie